癌细胞在侵袭过程中通过其前缘伪足骨架与细胞外微环境相互作用、感知力学限制并做出自适应性迁移反馈(图1)。因此,揭示癌细胞在复杂环境中自适应转移的蛋白质调控力学机制具有重要意义。然而,癌细胞的转移是一个极其复杂的、跨越多个时空尺度的动力学问题,涉及由分子尺度上多种蛋白基于力–化–生耦合互作行为,包括细胞骨架的聚合、组装、解聚、重塑等机制(图1)。因此,癌细胞转移微观机制的研究极具挑战。
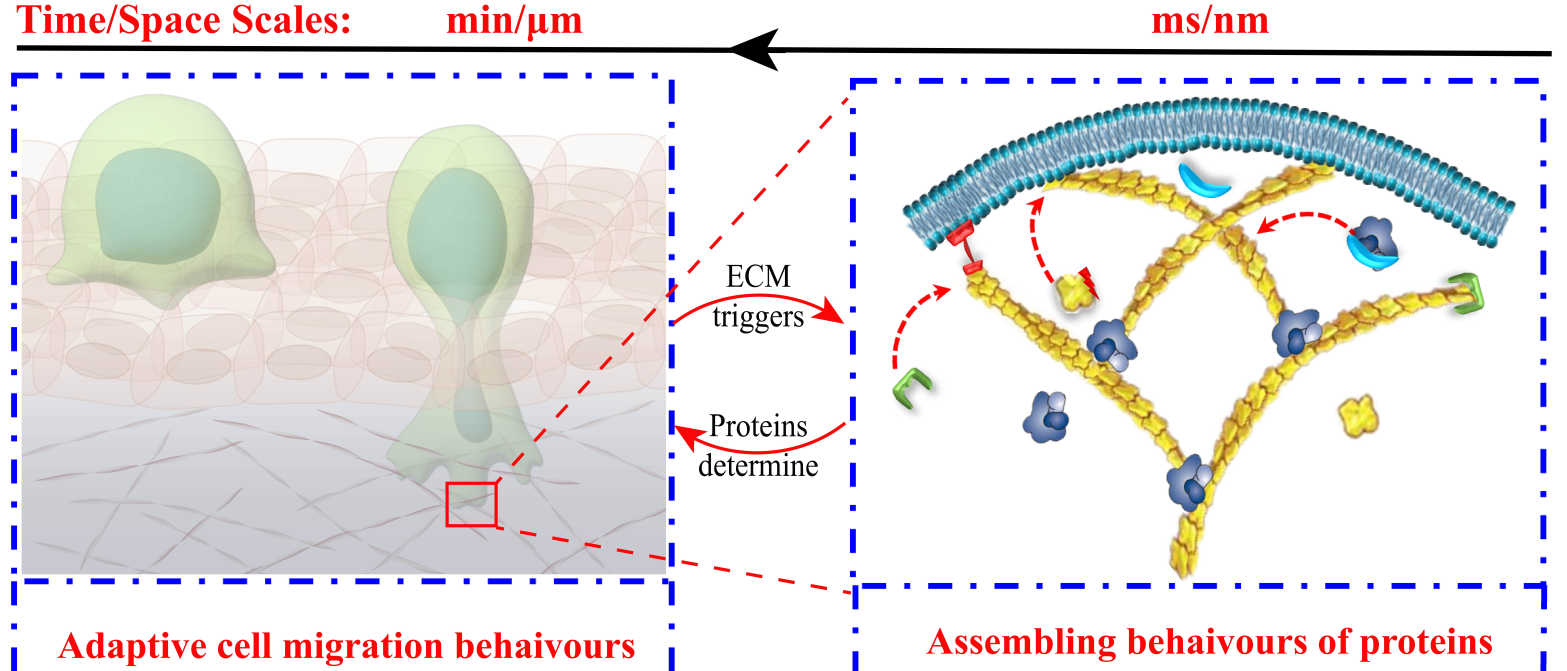
图1.癌细胞在侵袭过程中通过前缘伪足骨架与细胞外微环境互作,并做出自适应性迁移反馈
为回答上述问题,清华大学航院生物力学与医学工程研究所冯西桥教授团队基于聚合生长的肌动蛋白微丝变形和蛋白–蛋白互作分析,提出了基于力–化–生耦合机制的阻力自适应推进模型,构建了从蛋白到细胞的多尺度动态模拟系统。研究发现了细胞在复杂环境中迁移的正反馈机制(图2),即在细胞外微环境的限制下,伪足中聚合生长的肌动蛋白微丝将产生弯曲变形,这种构相变化会提高Arp2/3复合体在其外凸侧的亲和力,从而产生更多新的肌动蛋白微丝。通过这种反馈机制,细胞可以根据细胞外阻力大小自适应地调控伪足中分枝肌动蛋白网络的密度,从而调节其迁移的推动力。更有趣的是,肌动蛋白微丝弯曲变形的程度取决于细胞外基质阻力的大小,即阻力越大,弯曲变形越大,这是细胞感知环境阻力的反馈机制。
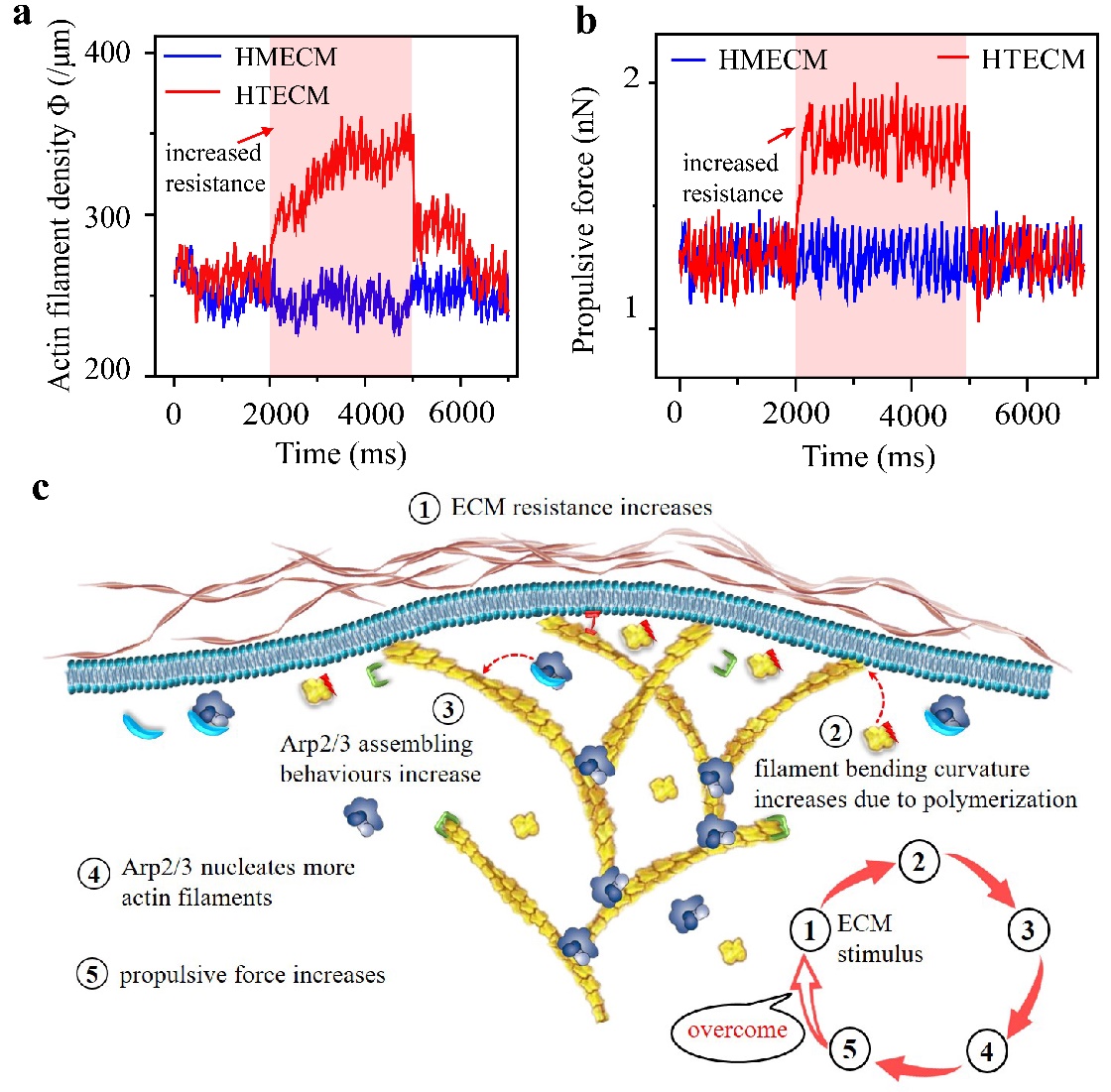
图2.细胞迁移的正反馈调节。(a)伪足骨架根据细胞外阻力环境的变化调控肌动蛋白微丝密度,(b)伪足骨架根据细胞外阻力环境的变化调控细胞迁移推进力,(c)细胞迁移的正反馈调节机制
本研究结合模拟与实验,进一步发现了高阻力激发的细胞迁移负反馈现象和调控机制,即当细胞外阻力过大时,伪足骨架中肌动蛋白微丝最终会停止聚合、Arp2/3复合体也将停止组装(图3)。这种负反馈使得细胞能够以最大效率利用其蛋白质和ATP资源。更重要的是,负反馈与正反馈的协同作用可以调控细胞的形貌、赋予细胞强大且灵活的迁移能力,以应对复杂的细胞外基质微环境(图3)。此外,该研究还进一步揭示了细胞方向性迁移的决策机制。
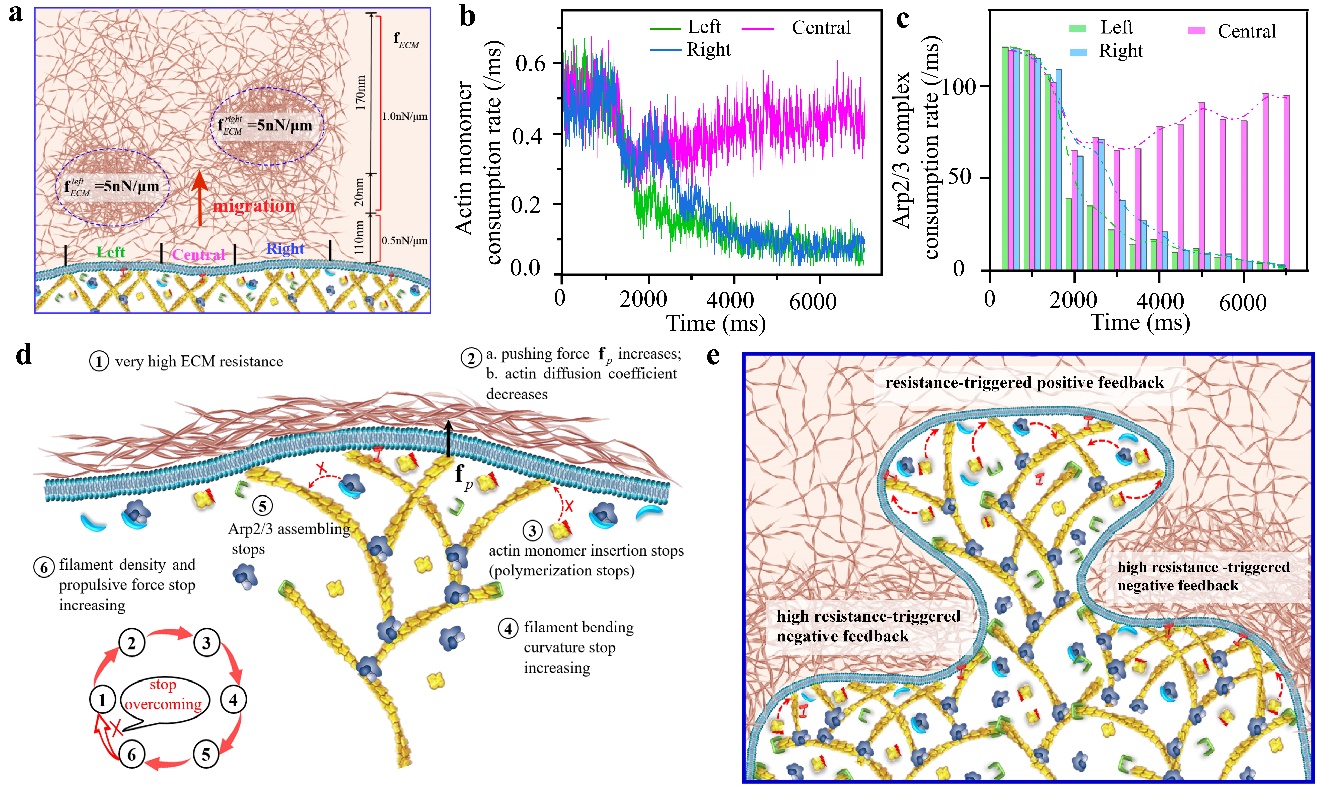
图3.细胞迁移的负反馈调节。(a)细胞外微环境的阻力分布;(b)在异质的细胞外微环境中,细胞迁移的肌动蛋白单体聚合速率;(c)在异质的细胞外微环境中,细胞迁移的Arp2/3复合体组装速率;(d)细胞迁移的负反馈调节机制;(e)正负反馈的协同调控细胞形貌的演化
癌细胞如何感知复杂的细胞外微环境,并寻找侵袭路径,一直以来是一个未解之谜,冯西桥教授团队发现是聚合力调控的肌动蛋白微丝与Arp2/3复合体互作主导了自适应细胞迁移,揭示了癌细胞突破复杂环境限制、完成转移的蛋白质调控力学机制,这一发现不仅深化了对癌细胞侵袭机制的认识,而且为抗癌药物开发提供了新的启示。
8月29日,上述成果在《美国科学院院报》(Proceedings of the National Academy of Sciences)在线发表了题为“聚合力调控的肌动蛋白微丝与Arp2/3复合体互作主导自适应细胞迁移”(Polymerization force-regulated actin filament-Arp2/3 complex interaction dominates self-adaptive cell migrations)的论文。
清华大学冯西桥教授、英国卡迪夫大学朱汉兴教授、清华大学陈新栋博士后为该论文的共同通讯作者,陈新栋博士后为第一作者。参与该研究的还有法国原子能和替代能源委员会细胞骨架形态学实验室李昱辉博士后、美国麻省理工学院细胞力学实验室郭明副教授等。该研究得到国家自然科学基金项目的资助。
论文链接:
https://www.pnas.org/doi/10.1073/pnas.2306512120